英语周报 高一第14答案


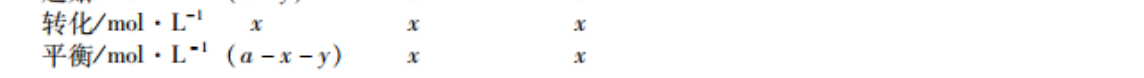
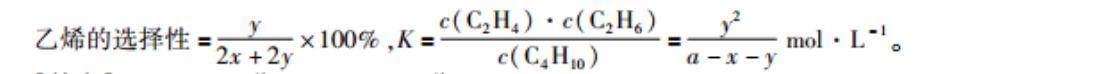
28.【答案】(1)+30(2分)(2)BC(2分(3)向右(1分)减小(2分)(4)Ⅱ(1分)(5)P1(2分)(6)-y2x+2×100%(2分)(2分)【解析】(1)分别写出表示燃烧热的热化学方程式:(a)CHlo(g)+02(g)=4CO2(g)+5H20(1)MH=-2878k·mol(b)C2H4(g)+302(g)=2CO2(g)+2H2O(1)△H=-1411kJ·mol(c)C2H4(g)+02(g)=2C02(g)+3H2O(1)MH=-1560kJ·mol2051-2878)kJ·ml=+63k·mll。MH1-△H2=+30k·m°同理,△H2=(890+(2)密度始终不变,A项错误;压强由小到大,不变时达到平衡,B项正确;摩尔质量由大到小,不变时达到平衡,C项正确;起始反应后,甲烷、丙烯的浓度之比为定值,D项错误。(3)相当于缩小体积,平衡向左移动,丁烷的转化率降低。通入丁烷,平衡仍然向右移动。(4)反应①是吸热反应,升高温度,平衡常数K增大,曲线Ⅱ符合题意。(5)气体分子数增大,增大压强,平衡向左移动,丁烷转化率减小,故p最大。(6)起始时c(CAH0)=amol·L。用三段式计算:C4H10(g)=C2H4(g)+C2H6(g起始/mol·L00转化/mol·I平衡/mol·Ll(a-yChO(g)=CH (g)+ C,H(g)起始/mol·L-(a-y)00转化mol平衡/mol·Ll(a-x-y)x乙烯的选择性c(C2H4)·c(C2H6)2x+)-×100%,Kc(C4H10)


17.(1)H:C::C:H(2分)2)能耗低(或产物易分离,2分)(3)45(2分)(4)C2H(g)+CO2=C2H(g)+(O(g)+H2O(1)△H=+133.2kJ·mol-(2分);积碳能与CO2反应生成CO,从而脱离催化剂表面(2分)(5)氢气移出率增大,体系中氢气的浓度降低,平衡正向移动,乙烷的平衡转化率增大(2分);90%(2分)【解析】本题主要考查化学反应原理,考查学生对化学反应原理的理解能力和综合运用能力。HH(1)乙烯电子式为H:C::C:H(2)氧化裂解反应是放热反应,节约能源(3)因为总压恒定为100kPaC2H(g)2(2(g)C2H4(g)+HyO(g)平衡分压2.4%×100kPa4%×100kPa18%×100kPa12%×100kPa该温度下的平衡常数K2=486×10×12%×10045(kPa)(2.4%×100)×(4%×100)(4)由盖斯定律①一②+③得热化学方程式C2H(g)+CO2=C2H4(g)+CO(g)+H2O(1),则△H=(+136kJ·mol)-(-283.0kJ·mo-)+(-285.8kJ·mol-1)=+133.2k·mol-l;该工艺中碳与CO2反应生成CO,可以有效消除催化剂表面的积炭,维持催化剂活性(5)氢气移出率增大,生成物中氢气的浓度降低,有利于平衡正向移动,乙烷转化率增大;A点时乙烷的转化率为90%,生成H2的总物质的量为0.9mol,设平衡时体系中H2的物质的量为x,平衡体系中,c(乙烷)=0.1mo·-,c(乙烯)=0.9ml.1-,c(H1)=xmol·L,平衡常数K=0=0.,解得x0.09mol,则氢气移出率a≈=9.9-0.090.9×100%=90%

以上就是英语周报 高一第14答案,更多英语周报答案请关注本网站。






