2021-2022高三英语外研周报第五十四期答案




18.【答案】(1)S(正交,s)+O2(g)=S02(g)△H-296.83k·mol(2分)(2)反应①是放热反应,开始时温度升高较快温度升高使反应速率加快,所以开始时生成SO2的物质的量增大较快,随着反应的进行,O2浓度减小,且体系温度升高不明显,O2浓度变化的影响大于温度的影响,生成SO2的物质的量增大较慢,达到平衡后保持不变(2分(3)①K1>K2>K1(1分)②C(1分(4)①<(1分)>(1分)②90%(2分)(0.078×2340.6803,(MPa)(2分)(0.078×234)×(0.078×2.34【必备知识】本题考查的必备知识包括键能、盖斯定律、电离常数的有关计算等。【关键能力】本题考查的关键能力侧重于分析与推测能力。【解题題思路】(1)根据盖斯定律由反应①-②得表示正交硫(s)的燃烧热的热化学方程式S(正交,s)+02(g)=S02(g)△H=-296.83k·mol'。(2)反应①是放热反应,开始时温度升高较快,温度升高使反应速率加快,所以开始时生成SO2的物质的量增大较快,随着反应的进行,O2浓度减小,且体系温度升高不明显,O2浓度变化的影响大于温度的影响生成SO2的物质的量增大较慢达到平衡后保持不变。(3)①放热反应,温度升高,平衡常数降低。2S02(g)+催化剂O2(g)2SO3(g)是放热反应,温度越高,平衡常数K越小,故K1>K2>K3。②502和SO3浓度相等是一种反应状态,不能作为反应达到平衡的标志,A错误;SO2与O2的反应是可逆的,O2不可能没有剩余,B错误;该反应正向进行时放热,容器中气体的温度保持不变说明反应达到平衡状态,C正确;容器中混合气体的总质量一定,体积定,气体的密度不会变化D错误。(4)①依图判断,T℃下的反应先达到平衡,速率快,温度高;A点反应未达到平衡,正反应速率大于逆反应速率。②设起始时二氧化硫的物质的量为2mol,氧气的物质的量为1mol,B点时O2转化的物质的量为xmol,列三段式如下:2SO2(g)+O2(g)=250,(g)起始物质的量/mol20改变物质的量/mol2平衡物质的量/mol2-2x则有1+2-0.m,解得x=0.9二氧化硫的转化率为0.9×22×100%=90%。③设起始二氧化硫的物质的量为2mol,氧气的物质的量为1mol,C点时O2转化的物质的量为ymol,列三段式如下:2SO2(g)+O2(g)==2S0,(g)起始物质的量/mol20改变物质的量/mol21平衡物质的量/mol2-2y0.10,解得y=06,则平衡时气体的总物质的量1-y+2y0.0782+11.32(0.078为234ml,平衡常数K0.684,(MPa)。0.(0.078)2×(0.078×4

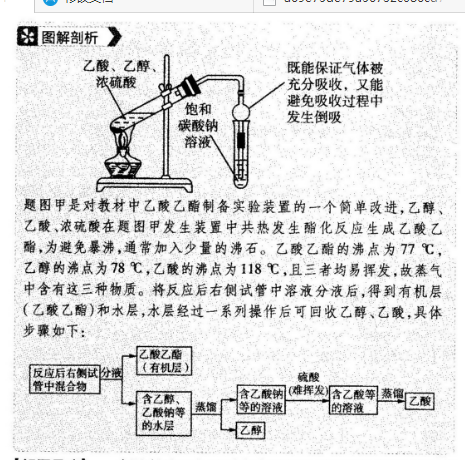

8.A【必备知识】本题考查的必备知识包括乙酸乙醋的制备、混合物的分离等【关键能力】本题考查的关键能力侧重于分析与推测能力、探究与创新能力。【学科素养】本题考查的学科素养侧重于思维方法、实践探索图解剖析》乙酸、乙醇既能保证气体被浓硫酸充分吸收,又能饱和避免吸收过程中碳酸钠发生倒吸溶液题图甲是对教材中乙酸乙酯制备实验装置的一个简单改进,乙醇乙酸、浓硫酸在题图甲发生装置中共热发生酯化反应生成乙酸乙酯为避免暴沸,通常加入少量的沸石。乙酸乙酯的沸点为77℃乙醇的沸点为78℃,乙酸的沸点为118℃,且三者均易挥发,故蒸气中含有这三种物质。将反应后右侧试管中溶液分液后,得到有机层乙酸乙酯)和水层,水层经过一系列操作后可回收乙醇、乙酸,具体步骤如下:乙酸乙酯反应后右侧试份被(有机层硫酸「含乙醇唐含乙酸钠雄挥发含乙酸等蒸龟乙酸钠等蒸缩等的溶液的溶液亿乙酸的水层【解题思路】一定温度下乙酸、乙醇在浓硫酸中发生酯化反应,浓硫酸起到了催化作用和吸水作用,加大了酯化反应的速率,并使平衡右移,提高乙酸乙酯的产率,但不能提高该酯化反应的平衡常数K(仅与温度有关),故A错误。根据上述分析可知,球形干燥管具有增强蒸气冷凝吸收和防倒吸的作用,故B正确。由上述分析知,反应后右侧试管中混合物先经过分液操作获得上层乙酸乙酯和下层的水溶液,故A是乙酸乙酯,下层水溶液经过蒸馏可得到乙醇,C溶液中含有乙酸钠,加入高沸点的硫酸酸化后,再蒸馏,可获得乙酸,故C、D正确。

以上就是2021-2022高三英语外研周报第五十四期答案,更多英语周报答案请关注本网站。






