英语周报高一2023–2022第35期答案


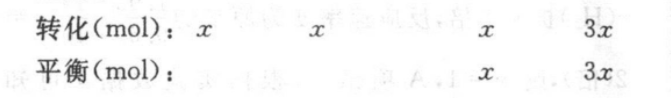


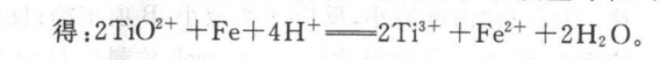
13.(20分)(1)①+165kJ·mo1-1(2分)②一定温度范围内,催化剂的活性较大,维持反应速率较快(合理即给分)(4分)③0.4(2分)(2)①B(2分)②80%(2分)》③生成的部分CO2及水蒸气可循环利用;该工艺中较大比例的H2作还原剂,可减少CO2的排放(只要答一点即可)(4分)(3)2TiO2++Fe+4H+-2Ti++Fe2++2H2 O(4分)》【解析】(1)①根据盖斯定律i×2-ⅱ可得:CH(g)+2H2O(g)CO2(g)+4H2(g)AH=+165kJ·mo1-1②一定温度范围内,催化剂的活性较大,维持反应速率较快。③根据三段式求解可得:CH(g)+H2O(g)CO(g)+3H2(g)起始(mol):转化(mol):xx3x平衡(mol):Ax3xCH(g)+CO2(g)2CO(g)+2H2 (g)起始(mol):转化(mol):y2y2y平衡(mol):2y2y则x十2y=0.3,3x十2y=0.5,解得x=0.1,y=中0.1,则通入催化反应室CH4的起始物质的量为0.2 mol++0.1 mol++0.1 mol=0.4 mol.(2)①由反应i的化学方程式可知,该反应是反应前后气体体积不变的反应,增大压强,平衡不移动,©0和二氧化碳的浓度同等倍数增大,则02不变,A项错;该反应的正反应方向为放热反应,降低温度,平衡正向移动,所以CO的浓度减小,二氧化碳的浓度增大,则S(C0)c(CO)增大,B项正确;增加纯固体或纯液体的量,平衡不移动,所以增加Fe2O3(s)用量,平衡不移动,C0和二氧化碳的浓度不变,则c(C02)c(CO不变,C项错②根据三段式求解可得:Fe2O3(s)+3C0(g)=2Fe(s)+3CO2(g)起始(mol):20转化(mol):xx平衡(mol):2-xx该温度下化学反应平衡常数K=2(2-x)=64,解得x=1.6,故C0的转化率为1×10%=80%。③由流程图可知,天然气竖炉冶铁相对于传统焦炭冶铁,优点是生成的部分CO2及水蒸气可循环利用;该工艺中较大比例的H2作还原剂,可减少CO,的排放。下(3)往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,说明有T3+(紫色)生成,则铁与TiO+反应生成了T3+(紫色),Ti元素的化合价从十4价降低为+3价,被还原,则铁被氧化,由于T3+(紫色)可被铁离子氧化为TO+,所以铁被氧化为亚铁离子,再根据化合价升降法、电荷守恒和质量守恒可得:2TiO2++Fe+4H+-2Ti3++Fe2++2H2O。

7.B【解析】使用催化剂可以降低过氧化氢分解反应的活化能,但不能改变反应的焓变,A项错误;MnO2或FCl3可以催化H2O2分解反应,B项正确;催化剂可以加快反应速率,是因为催化剂能够改变反应路径,降低反应所需活化能,C项错误;根据图示,H2O2分解反应中反应物总能量高于生成物总能量,为放热反应,D项错误。

以上就是英语周报高一2023–2022第35期答案,更多英语周报答案请关注本网站。






