英语周报八年级上册人教版的答案



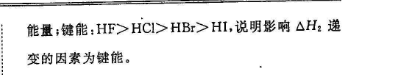
7.(15分)(1)口(分)33p(2)4(2分)(3)>(1分)4)①H-OC-O(或H-0-C→0)(2分)s(2分)d键和x键(或极性键)(2分)氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高导致C-O一H中O的电子越向C1偏移越易电离出H+(2分,其他合理答案也给分)②HF的水溶液中存在氢键作用(1分)原子半径(或键长或键能)(1分)【解析】(1)基态Si原子的价电子轨道表达式为团团口(2)铝的未成对电子数为1,第四周期中,未成对电子数为1的金属元素有K、Se、Cu、Ga,共4种(3)Na+和Ne互为等电子体,电离能:L2(Na)>I,(Ne)(4)①HClO4是一元酸,其结构式为H-OC=o也可写为H-o-→0;HCO3中C原子的价层电子对数为4,杂化轨道类型为sp;HClO2的结构式为H-0Cl-0(或H-OCl→O),所含化学键为极性共价键既有键又有x键氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高正电性越高,导致C}-O一H中O的电子越向C1偏移,越易电离出H+,酸性越强②HF分子与水分子间存在氢键电离时需要更多的能量;键能:HF>HC>HBr>HI,说明影响△H2递变的因素为键能


2:(10分)(1)第四周期第Ⅷ族(2分)(2)sp2、sp3(2分)(3)FG(2分)(4)CO2中C原子的价层电子对数为2,孤电子对数为0,由 VSEPR模型知,两对电子对应尽量远离,故为直线形结构(2分)(5)配位键(2分)【解析】(1)铁元素在周期表中的位置为第四周期第Ⅷ族。(2)M中连接双键的碳原子采用sp2杂化,连接4个单键的碳原子采用sp2杂化(3)原子总数相同、价电子总数相同的粒子互为等电子体。CO2为三原子16电子,SO2、NO2为三原子18电子(4)CO2中C原子的价层电子对数为2+2×(4-22)=2,孤电子对数为0,由 VSEPR模型知,两对电子对应尽量远离故为直线形结构,CO2分子为直线形分子(5)M中还存在配位键

以上就是英语周报八年级上册人教版的答案,更多英语周报答案请关注本网站。






