2019-2022七年级英语周报新目标答案

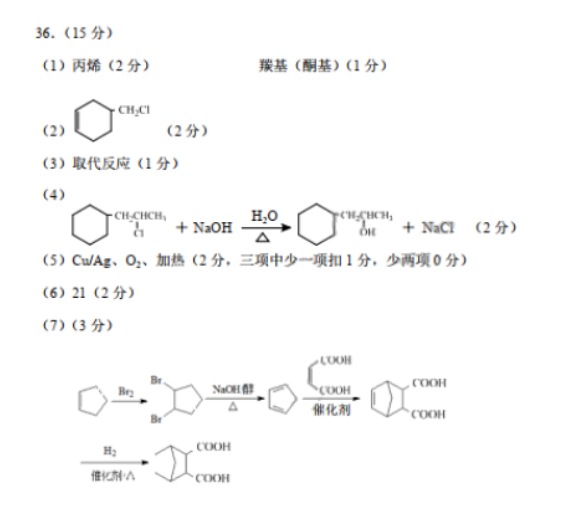
36.(15分)(1)内烯(2分)羰基(酮基)(1分)(2)(2分)(3)取代反应(1分)H, Ob+NoH=△M+NaC1(2分)(5)Cu/Ag、O2、加热(2分,三项中少一项扣1分,少两项0分)(6)21(2分)(7)(3分)LUDH0=D=.wCOoHOoHCOOH倍化剂A(oH


16.(1)Fe+NO2+4H一Fe3+N()↑+2H:0(1分)Fe--2Fe3Fe3+(1分)Fe+2HH2↑(1分)(2)0.2mol(2分)2mo!·1.-(2分(3)H、NO万、A13、SO;-、Cl-(2分)3Cu+8H+2NO3Cu2+2NO↑+4H:O(1分)(4)3,36L(1分)【解析】(1)由图像可知,由于硝酸过量,OA段发生反应的离子方程式为Fe+NO3+4H=Fe3+NO↑十2H:O,AB段发生反应的离子方程式为Fe+2Fe=3Fe2,BC段发生反应的离子方程式为Fe2H一Fe2++H2↑(2)OA段消耗11.2gFe,即0.2 mol Fe.由离子方程式Fe+NO+4H=Fe++NO↑+2H2O可知,消耗HNO3的物质的量为0.2mol,因此原混合酸中NO3的物质的量为0.2mol;最终消耗22.4gFe,即0.4molFe,最后溶液中溶质为FeSO4,根据Fe元素守恒可得n(FeSO4)=0.4mol,则n(H2SO,)=0.4mol,原混合酸中H:SO4的物质的量浓度为4mol-=2mol·L3)pH=1的某溶液中H浓度为0.1mol·L-',说明溶液中无CO。向溶液A中加入过量的(NH4)2CO3溶液,Fe-与CO”发生相互促进的水解反应,生成红褐色沉淀,故可以排除Fe+,生成白色沉淀甲,则原溶液中一定有A'+;向溶液乙中加入铜和硫酸能产生气体丙,气体丙在足量空气中转化成红棕色气体丁,可知气体丁为NO2,气体丙为NO,则原溶液中有NOa,在酸性条件下NO具有强氧化性,则一定不存在I根据以上分析可知,溶液中存在离子浓度均为0.1mol·L的H”、A|-、NO,溶液中阳离子带有的电荷浓度为(0.1mol·L1×1)+(0.lmol·L×3)=0.4mol·L-;而溶液中除了存在0.1mol·Lt的NO3外,根据电荷守恒,还应该含有SO-和C1-,所以该溶液A中一定有H、NO、A1+、SO:-、C!五种离子,溶液乙与铜、硫酸反应的离子方程式为3Cu+8H+3NO3=3Cu2++2NO↑+4H2O。(4)14.4g铜的物质的量为14g=0.225m0,64g根据铜与稀硝酸反应的化学方程式可知,在标准状况下,生成NO气体的体积V(NO)=-n(Cu)×Vn0.225mol×22.4L·mol-l=3.36L3

以上就是2019-2022七年级英语周报新目标答案,更多英语周报答案请关注本网站。






