2022英语周报 八年级新目标 第14期答案


6.D调查植物丰富度可采用样方法,不能以每个样方物种数的平均值为估计值,D错误



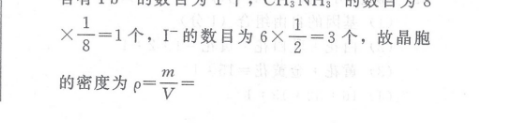

35.(15分)(1)132s2p3s23p53d4s2或[Ar]3d4s2(1分(2)TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高(1分)(3)O>T>Ca(1分)(4)离子键(1分)(5)12(2分)(6)Ti(1分)(7)sp3(1分)620(8)a×N.×1021(2分)(9)2Eu3++Pb=2Eu2++Pb2+(2分)(10)2Eu2++12=2Eu3++21(2分)【解析】(1)钛元素是22号元素,故其基态原子的核外电子排布式为1s2s22p3s23p°3d24s2或Ar]3d4s2;故答案为1s2s2p3s23p3d24s2或[Ar]3d24s2;(2)一般不同的晶体类型的熔沸点是原子晶体>离子晶体>分子晶体,TiF4是离子晶体,其余三种则为分子晶体,故TF4的熔点高于其余三种物质;TiC4、TiBr4、Til4均为分子晶体,对于结构相似的分子晶体,则其相对分子质量越大,分子间作用力依次越大,熔点越高;故答案为TiF4是离子晶体,其余三种则为分子晶体,故TF4的熔点高于其余三种物质;TiC1、TiBr4、TiIl4均为分子晶体,相对分子质量依次增大,分子间作用力依次增强,故熔点依次升高;(3) CaTio3晶体中含有Ca、Ti、O三种元素,Ca、Ti是同为第四周期的金属元素,Ca在Ti的左边,根据同一周期元素的电负性从左往右依次增大,故T讠>Ca,O为非金属,故其电负性最强,故三者电负性由大到小的顺序是:O>Ti>Ca,金属阳离子和氧负离子之间以离子键结合,离子晶体晶胞中某微粒的配位数是指与之距离最近且相等的带相反电性的离子,故Ca2+的配位数必须是与之距离最近且相等的氧离子的数目,从图(a)可知,故Ca2+的配位数是12;故答案为O>T>Ca;离子键;12;(4)比较晶胞(a)(b)可知,将图(b)中周围紧邻的八个晶胞中体心上的离子连接起来,就能变为图(a)所示晶胞结构,图(b)中体心上的Pb+就变为了八个顶点,即相当于图(a)中的Ti+;图(b)中顶点上的I就变成了体心,即相当于图(a)中的Ca2+;图(b)面心上中的CH3NH就变成了棱心,即相当于图(a)中的O2-;故图(b)中的Pb2+与图(a)中的Ti+的空间位置相同;有机碱CH3NH中N原子上无孤对电子,周围形成了4个a键,故N原子采用sp3杂化;从图(b)可知,一个晶胞中含有Pb2+的数目为1个,CH1NH的数目为8=1个,1的数目为6×。=3个,故晶胞的密度为P=v=1mol×(207+3×127+12+14+6×1)g/molNA×(a×10-7)3620×1021,故答案为Ti4+;sp3;20×102;N(5)从作用原理图(c)可以推出,这里发生两个离子反应方程式,左边发生Pb+2Eu3+Pb2++2Ea2+,右边发生I2+2El22Eu3++2I-,故答案为:Pb+2Eu3+Pb2++2Eu2+;I2+2Eu2+=2Eu23++2rI

以上就是2022英语周报 八年级新目标 第14期答案,更多英语周报答案请关注本网站。






