英语周报 2018-2022 高二 北师大 17答案


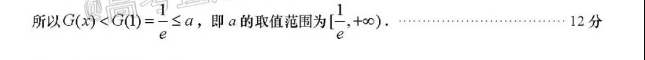
21,(本小题满分12分)解:(1)因为f(x)=ae2lnx,所以f(x)=ae(nx+-)x∈(0,+∞)令k(x)=lnx+-,则k(x)当x∈(O,1)时,k(x)<0,函数k(x)单调递减当x∈(1,+∞)时,k(x)>0,函数k(x)单调递增高考所以k(x)≥k(1)=1>0,4分又因为a>0,e>0所以∫(x)>0,f(x)在定义域(0.+∞)上单调递增5分(2)由x)>0得g(x)f(x)>0,即 ge In x
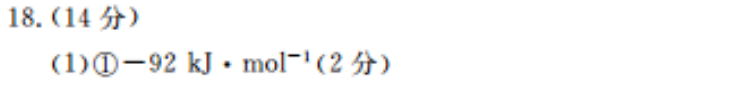


18.(14分)(1)①-92kJ·mol-(2分)②124(1分)N2+3·H2=2·N+6·H(2分)(2)①10%(2分)②0.0225mol·L-·min-1(2分(3)①L2(1分)该反应的正反应为放热反应,升高温度平衡逆向移动,逆反应的平衡常数增大(2分)②1(2分)【解析】(1)①由图中信息知,△H=-(500-308100)kJ·mo-=-92kJ·mol-②对总反应速率影响较小的步骤为反应速率快、活化能小的步骤,由图可知,·N2+3·H2转化为2·N+6·H的活化能小,对总反应速率影响小,其活化能为(90+34)kJ·mol-,该步骤的化学方程式为·N2+3·H2-2·N+6·H。(2)①起始加入N2和H2的物质的量之比等于化学计量数之比,故平衡时二者的体积分数之比为1:3则N2的平衡体积分数为1-60%=10%,②设平衡时NH3的物质的量为xmol,依据三段式列式得,-x×100%=60%,解得x=1.5,由此推知参加反应的H2的物质的量为2.25mol,0~10min内,uH,2. 25 mol10 LX10 min=0.0225mol·L-·min-1,(3)①合成氨反应为放热反应,升高温度平衡逆向移动,逆反应的平衡常数增大,正反应的平衡常数减小,则L2表示逆反应的平衡常数与温度变化关系的曲线。②由图可知,T℃时,正、逆反应的平衡常数相等且互为倒数故该温度下K。(正)=K.(逆)=1。由平衡时正、逆反应速率相等可知,1=远=k·CN)·d(H2)m1k·c2(NH3)

以上就是英语周报 2018-2022 高二 北师大 17答案,更多英语周报答案请关注本网站。






