英语周报高二课标综合OT第一期答案


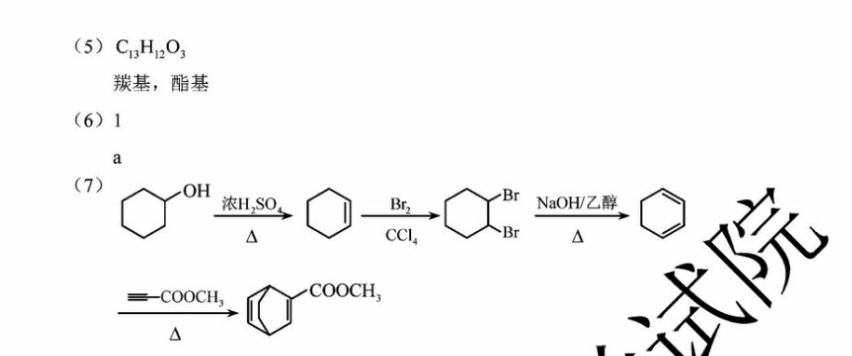
(共18分)cHo HCCHOHC=CHCH CHO H,CEchNCHO(2)4(3)≡COOH(4)加成反应(5)C3H12O3羰基,酯基(6)1(7)OH浓HSONaOH乙醇CCI-COOCHCOOCH




3.(28分)(1)自旋(2分2rs22p5333p3d4324p3(或[Ar]3d4s24p3)(2ˇ分)Br、Kr(3分)(3)sp3(2分)(4)①2H3AsO3+3H2S=As2S3+6H2O(3分)②平面三角形(2分)③<(2分)H3AsO3可表示为(HO3As,非羟基氧的个数为0,HNO2可表示为(HONO,非羟基氧的个数为1,非羟基氧的个数越多,中心原子的正电性越高,导致羟基氧中氧的电子向中心原子偏移,越易电离出氢离子,故HNO2的酸性强于H3AsO2(4分)(5)① LiFeas(2分)②(3,1,4’4,2)(3分)138×4NAX(.53×10-)3(3分)【解析】(1)量子力学把电子在原子核外的一种空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态称为自旋。(2)基态As原子的核外电子排布式为1s2s2p53s23p°3d04s24p3或[Ar]3d04s24p3;同周期元素从左向右第一电离能呈增大趋势,但As原子最外层3p能级为半充满的稳定状态,其第一电离能大于Se,故第一电离能大于As元素的是Br和Kr(3)根据雄黄的结构图可知,As原子形成3个a键,有1对孤电子对,因此As的杂化轨道类型为sp3。(4)①雌黄的分子式为As2S3,则反应Ⅲ的化学方程式为2H3AsO3+3H2S=A2S3+6H2O②SO2中心原子S形成2个键,孤电子对数为(6-2×2)=1,价层电子对数为3,因此SO2的VSEPR模型为平面三角形。③H3AsO3为三元弱酸,不含非羟基氧,HNO2中含有1个非羟基氧,非羟基氧越多,中心原子的正电性越高,导致羟基中氧的电子向中心原子偏移,越容易电离出氢离子,故HNO2的酸性强于H3AsO3。(5)①根据晶胞的结构,L位于晶胞内部,有4个,Fe位于顶点棱心面心,个数为8×B+8×4+2×℃2=4,As位于晶胞内部,有4个,因此晶体的化学式为 LiFeAs②根据1号和2号原子的坐标推出3号原子的坐标为(138×4③一个晶胞的质量为NA8,晶胞的体积为0.53×10-7)3cm3,则晶胞的密度为138×4NA×(0.53×10-)5g·cm3。

以上就是英语周报高二课标综合OT第一期答案,更多英语周报答案请关注本网站。






