英语周报2021-2022初二。答案




26.(除特殊标注外,每空2分,共14分)(1)①蒸馏烧瓶(1分)平衡压强,使浓盐酸顺利流下②除去氯气中的氯化氢③提供碱性环境,确保K2FeO4稳定存在,提高产率@3C1+2Fe(OH)+10OH-2Fe07-+6CI+8H,O(2)不能(1分)粗品中可能混有KCIO,酸性环境下可与CI反应产生Ch2(3)50%〖解析】利用KMnO4与浓盐酸反应制得C2,将Cl2通过饱和NaCl溶液除去HC,纯净的Ch2通入含有Fe(OH)的KOH溶液中,制备高效水处理剂高铁酸钾(K2FeO4)(1)①装置A用于制取Cl,其中盛放KMnO4的烧瓶侧面带有支管应为蒸馏烧瓶,为了防止因反应过于剧烈烧瓶内压强增大前使液体无法滴落,通过橡胶管将分液漏斗与蒸馏烧瓶连通平衡体系的压强,确保浓盐酸能顺利流下。②由于盐酸具有挥发性,所得C2中混有HC1和HO(g),HC1会消耗Fe(OH)3、KOH,用饱和NaCl溶液除去HCl③由题日已知信息可知K2FeO4在酸性或中性环境下不稳定,在碱性环境中能稳定存在,可知装置C需要确保碱性环境,即需KOH溶液过量。④装置C在碱性条件下用Cl2将Fe(OH3氧化生成KFeO4,反应的离子方程式为3C1+2Fe(OH)+IOOH2Fe02-+6CI+8H.0(2)根据上述制备反应,装置C的紫色溶液含有KFeO4、KCl,还可能含有KClO等,酸性条件下CO可与C反应产生Cl2,所以不能说明酸性条件下FeO氧化性强于Cl2(3)若在制备装置C中加入FeOH)3的质量为107g,充分反应后经过滤、洗涤、干燥得KFeO4固体99g,根据铁原子守恒Fe(OH)) K,FeO419810.7则理论产量m198,故KFO的产率为2×10%=5%19.88

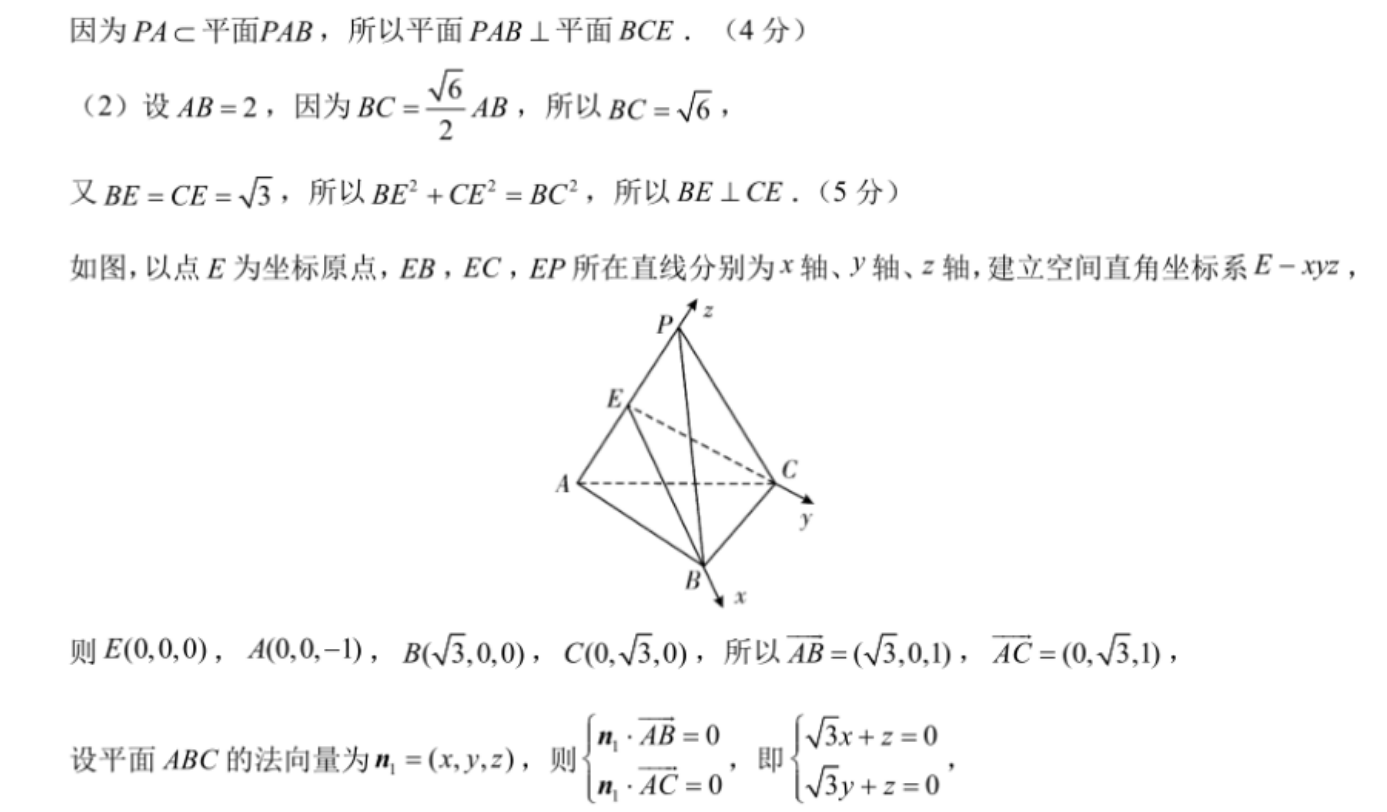

19.(12分)【解析】(1)因为PB=AB,E是PA的中点,所以PA⊥BE,(1分)同理可得PA⊥CE,(2分)因为BE∩CE=E,所以PA⊥平面BCE.(3分)因为PAc平面PAB,所以平面PAB⊥平面BCE.(4分)(2)设AB=2,因为BC=AB,所以BC=√6,2又BE=CE=√3,所以BE2+CE2=BC2,所以BE⊥CE.(5分)如图,以点E为坐标原点,EB,EC,EP所在直线分别为x轴、y轴、z轴,建立空间直角坐标系E-xz,则E(0,0,0),A(00,-1),B(√3,0,0),C0、√3,0),所以AB=(3,0,1),AC=(0.√3,1),n1·AB=0x+z=0设平面ABC的法向量为n1=(x,y,z),则即n,·AC=0y+z=0令x=√3,可得z=-3,y=√3,所以平面ABC的一个法向量为n=(3,√3,-3),(8分)易知CE⊥平面ABE,所以平面ABE的一个法向量为n2=(0,1,0),(10分)所以 cos(n,n2)=√3√5n1|1n2|√15×1,(11分)所以二面角E-AB-C的正弦值为2y.(12分

以上就是英语周报2021-2022初二。答案,更多英语周报答案请关注本网站。






