2022深圳专版六年级英语教育周报答案



27.(15分)(1)KCO+6HC浓)K(1+3C2↑+3H2O2分)(2)ihdefg(gf) be(cb)de(2 s)(3)饱和食盐水(1分)硼粉与HCl气体反应生成H2,加热H2与Cl2的混合气体易发生爆炸(2分)(4)会生成B2O3,使产品不纯(2分)(5)BCl3+3H2O一H3BO3+3HCl(2分)2H2O4e-一02↑+4H+(2分)阳极室的H+穿过阳膜扩散至产品室,原料室的B(OH)穿过阴膜扩散至产品室,二者反应生成H3BO3(2分)【解析】(1)氯酸钾固体与浓盐酸反应制氯气的化学方程式为KCO3+6HCl(浓)一KC1+3Cl2↑+3H2O,(2)装置A制备氯气,制得的氯气中混有HC1和水蒸气,可用装置E中饱和食盐水吸收HC1气体,用装置C中浓硫酸吸水干燥,导气管均长进短出,干燥、纯净的氯气与硼粉在装置D中发生反应,装置B中冰水冷凝产物BCl并收集,装置F中NaOH吸收尾气,防止污染空气,为防止装置F中的水蒸气进入装置B,在装置B和装置F之间连接一个干燥装置C,故连接顺序为 aihdefg(gfb(cb)dej(3)装置E中为饱和食盐水,可以除去氯气中的HCl气体,若拆去装置E,硼粉与HCl气体反应生成H2,加热H2与Cl2的混合气体易发生爆炸,(4)装置D中发生反应前先通入一段时间的氯气,排尽装置中的空气。若缺少此步骤,氧气与硼粉会生成B2O3,使产品不纯。(5)三氯化硼与水能剧烈反应生成硼酸(H3BO3)和白雾,白雾为HCl,反应的化学方程式为BCl2+3H2O一H3BO3+3HC,由装置知,阳极的电极反应式为2H2O-4e-02↑+4Ht;阳极室的H穿过阳膜扩散至产品室,原料室的B(OH)穿过阴膜扩散至产品室,二者反应生成H3BO3


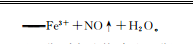
26.(12分,除标注外,每空1分)(1)NOz发生水解反应NOz+H2OHNO2+OHˉ,温度升高水解平衡正向移动,碱性增强,溶液红色加深(其他合理答案也给分(2)还原N原子最外层5个电子,十3价不稳定易失电子,体现还原性(其他合理答案也给分)(3)①浅绿色棕色0.5mol·L-Fe2(SO4)溶液(pH=3)②棕色溶液中的[Fe(NO)]受热生成NO和Fe2+,NO被空气氧化为NO2,加热有利于Fe2+被氧化为Fe3+,促进Fe+水解,产生Fe(OH)3沉淀(2分,其他合理答案也给分)(4)①阻碍Fe2+与NO接触,避免络合反应发生(2分,其他合理答案也给分)②Fe2++NO+2H一Fe+NO↑+H2O(2分)【解析】(1)NaNO2为强碱弱酸盐,NOˉ发生水解反应NOz+H2O←HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深。(2)KMnO4溶液紫色褪去,即KMnO4被还原,说NO2具有还原性。NO2具有还原性的原因是:N原子最外层5个电子,+3价不稳定,易失电子,体现还原性(3)①若要证明棕色物质是NO与Fe2+,而非Fe发生络合反应的产物,需要作对照实验,即pH均为3,含Fe2+和Fe3+物质的量浓度均为1mol·L-1的FeSO4溶液和Fe2(SO4)3溶液中通人NO,若通入FeSO4溶液出现溶液由浅绿色迅速变为棕色,而通人Fe2(SO4)3溶液无现象,则可证明。②气体在接近试管口处变为红棕色,说明有NO生成,溶液中有红褐色沉淀,说明有Fe(OH)3生成,原因是棕色溶液中的[Fe(NO]受热生成NO和Fe2+,NO被空气氧化为NO2,加热有利于Fe2+被氧化为Fe3,促进Fe3+水解,产生Fe(OH)3沉淀,(4)①由图可知,该装置构成了原电池,两电极分别产生NO和Fe3+,中间盐桥的作用是阻碍Fe2+与NO接触,避免络合反应发生②该原电池总反应方程式为Fe2++NOz+2H+Fe3++NO↑+H2O

以上就是2022深圳专版六年级英语教育周报答案,更多英语周报答案请关注本网站。






