2022 英语周报 高一 课标 57免费答案



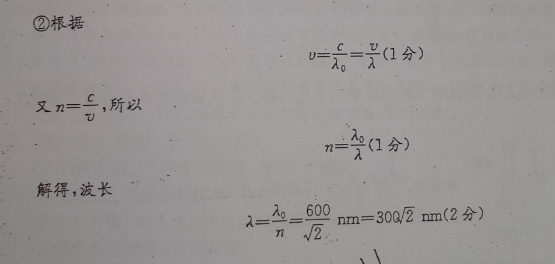
34.(1)ACE(2)①2②30Q2mm【解析】(1)A根据波形平移法可知:t=0时刻质点P、Q均沿y轴的负方向运动,则质点PQ的起振方向均沿y轴的负方向运动,两波源的起振方向均为y轴负方向,故A正确;质点P、Q在平衡位置附近振动,不会沿波的传播方向运动,故B错误;两列波同时到达M点,起振方向都沿负方向,所以M点的起振方向沿y轴负方向,所以C正确;由图知波长A0.4m,由v=个得,该波的周期为0.4U0.4则t=1s时刻,两列波谷都传播到M点,质点M的位移为故E正确,D错误。故选ACEy=-2cm+(-2cm)=-4cm(2)①如图折射角正弦sinrsVR-(AB=(1分)r=30°(1分)根据光路可逆性和对称性可知,OC垂直AB,(1分)∠CAD=∠CBD=30=15(1分)入射角r+∠CAD=45°(1分)所以=√2(2分)sIn r.sIn②根据U==(1分)又n=C,所以(1分)解得,波长x=2=600m=302mm(2分)


16.参考答案(1)5(1分)前者为分子晶体,后者为离子晶体,分子间作用力弱于离子键故熔点前者低于后者(2分)(2)是(1分)C2H6(1分)N>O>C>B(1分)(3)氟原子电负性大,吸引电子能力强,与其成键的N原子偏向F原子,使氮原子提供孤对电子能力弱,不易与BF3中的B原子形成配位键(2分)3NA(1分)(4)1:4:4(1分)3LiAH4=LiAH+2A+3H2↑(2分)说明分析(1)基态原子含1个未成对电子的有B、H、Cl、Li、Al,共5种;B(OCH3)为分子晶体,熔化时破坏分子间作用力,NHC1为离子晶体,熔化时破坏离子键,分子间作用力弱于离子键,故熔点前者低于后者。(2)B为缺电子原子,有空轨道,N原子有孤对电子,NH3·BH2中存在配位键将B、N原子用2个C原子替换可以得到NH3·BH13的一种等电子体C2H6;同周期元素第一电离能随着原子序数增大而呈增大趋势,N元素原子2p能级为半充满稳定状态,它的第一电离能大于氧元素,故第一电离能N>O>C>B。(3)氟原子电负性大,吸引电子能力强,与其成键的N原子偏向F原子,使氮原子提供孤对电子能力弱,不易与BF3中的B原子形成配位键,所以NF3不易与BH3结合形成NF3·BH3。根据题意可知每个NH3分子可以形成6个氢键,每个氢键的二分之一属于该NH3分子,所以一个NH3分子具有6x=3个氢键,则1mol氨晶体中含氢键数目为3NA。(4)NHC1晶胞与CsC1类似,则晶胞中有1个阳离子,LCl与NaCl类似,则晶胞中有4个阳离子,图示晶胞中阳离子个数为4×+6×=4,所以三种晶胞中阳离子个数比为1:4:4。每3个AH中,有2个分别都释放出3个H原子和1个A原子,所以LiAH4分解的化学方程式为LiAH4=Li3AH4+2Al+3H2↑。

以上就是2022 英语周报 高一 课标 57免费答案,更多英语周报答案请关注本网站。






