2022英语周报八年级下册第42期答案




17(1)Cl(g)+NH3(g)==NH CI(g)+HCl(g) AH+11.3kJ·mo11(1分)(2)①c(1分)②(70×20%)×(0×60%(或(70×20%)2(2分)③反应放热,升温后平衡逆向移动,K减小(1分)催化剂活性最强(1分)(3)①0.01mol·L·s-1(1分)②增大NO2的浓度(1分)③小于(1分)大于(1分)a、b点各组分浓度相同温度a点高于b点,温度升高,化学反应速率加快(1分)④32(2分)【解析】(1)热化学方程式为Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)△H=反应物的键能之和一生成物的键能之和=(3×391.3+243.0)-(2×391.3+191.2+431.8)=+11.3(kJ·mol-1)。(2)①合成氨反应为放热反应,升高温度,平衡逆向移动,NH3的物质的量分数减小,故曲线a、b、c对应温度较高的是c;②根据图中的数据可知,b点NH3平衡时的物质的量分数为20%,总压强p=70MPa,起始投料比等于化学计量数之比,则b点时N2的物质的量分数为(1-20%)×÷=20%,H2的物质的量分数为0×20%20%×3=60%,则K,=(70×20%)×(70×60%或14;③合成氨反应是放热反应,升温后平衡逆向移动42故平衡常数随温度的升高而减小。工业上合成氨一般以α-铁触媒为催化剂,400~500℃条件下反应,选取该反应温度而非室温或更高温度的原因是催化剂活性最强2 U(NO,)△c(NO2)(3)①v(O2)=2△t0.6mol·L-1-0.4mol·L=0.01mol·L2×10s②T1温度下,要减少NO2的分解,并缩短达到平衡的时间.可采用增大NO)2的浓度;③温度由T:到T时,NO2平衡时浓度降低.则平衡正向移动.则Kr1
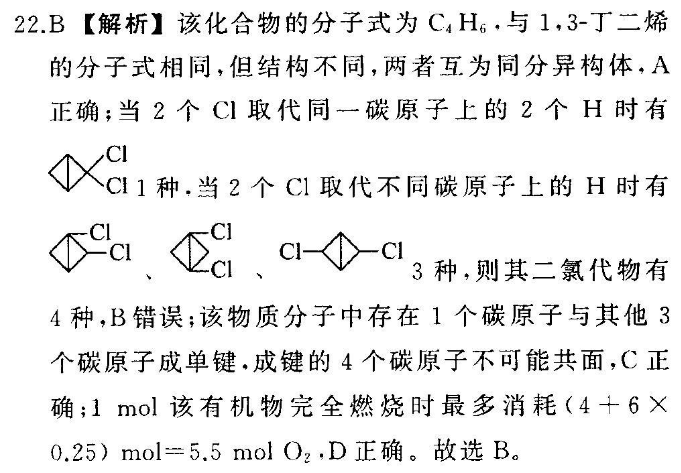
22B【解析】该化合物的分子式为CAH6,与1,3-丁二烯的分子式相同,但结构不同,两者互为同分异构体,A正确;当2个Cl取代同一碳原子上的2个H时有Cl1种,当2个Cl取代不同碳原子上的H时有CCICI3种,则其二氯代物有4种,B错误;该物质分子中存在1个碳原子与其他3个碳原子成单键,成键的4个碳原子不可能共面,C正确;1mol该有机物完全燃烧时最多消耗(4+60.25)mol=5.5molO2,D正确。故选B。

以上就是2022英语周报八年级下册第42期答案,更多英语周报答案请关注本网站。






