2019年至2022年英语周报七年级答案



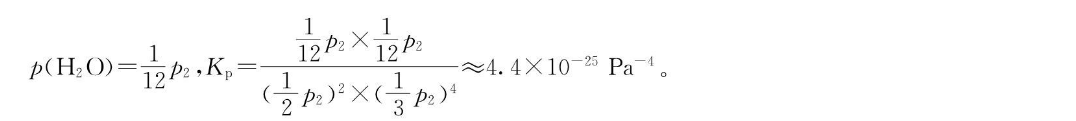
28.(1)-205.1(2分)(2)C(2分)(3)50%(2分);4.4×10-25(2分);BC(2分)(4)①向正反应方向(1分);向正反应方向(1分);高压(1分)②合成二甲醚的反应为放热反应,温度过高平衡逆向移动;催化剂在350℃失去了活性,反应速率下降(2分)【解析】本题主要考査化学反应原理,考査学生对化学反应原理的理解能力和综合运用能力。(1)根据盖斯定律:△H3=2△H1+△H2=-205.1kJ·moll。(3)设起始时压强为p1,平衡时压强为p2。2CO(g)+4H2(g)CH3 OCH3(g)+H2 o(g)起始物质的量(mol)变化物质的量(mol)2a4a平衡时物质的量(mol)2-2a2-4aap2:p1=(4-4a):4=(1-25%):1,推出a=0.25,H2的转化率为50%p2:加1=75%p2=2×105×75%Pa=1.5×106Pa,p(CO≈12 p2, p(H2)3 p2, p(CHy OCHs)28.(1)-205.1(2分)(2)C(2分)(3)50%(2分);4.4×10-25(2分);BC(2分)(4)①向正反应方向(1分);向正反应方向(1分);高压(1分)②合成二甲醚的反应为放热反应,温度过高平衡逆向移动;催化剂在350℃失去了活性,反应速率下降(2分)【解析】本题主要考查化学反应原理,考查学生对化学反应原理的理解能力和综合运用能力(1)根据盖斯定律:△H3=2△H1+△H2=-205.1kJ·mol(3)设起始时压强为力1,平衡时压强为p2。2CO(g)+4H2(g)CH3 OCH3(g)+H2o(g)起始物质的量(mol)20变化物质的量(mol)平衡时物质的量(mol)2-2a2-4ap2:p1=(4-4a):4=(1-25%):1,推出a=0.25,H2的转化率为50%。p2:p=75%p2=2×10×75%Pa=1.5×105Pa,p(CO)=12 pz, p(H2)=3p2,p(CH, OCH12p2×12pp(H2O)=1op2,Kp≈4.4×1025Pa-4(p2)2×(2p2)4


I.(1)正极(1分)Fe3++eFe+(2分)(2)银(1分)(3)产生白色沉淀,电流表指针向左偏转(2分)Ⅱ.(4)HS-+4H2O-8e=S0?+9H+(2分)(5)H、SO浓度不会发生变化,只要有两种细菌存在,就会循环将有机物氧化成CO2放出电子(2分)【解析】I.(1)由题意可知,石墨作正极,电极反应式劫Fe++e-Fe2+2)原电池中,阴离子向负极移动,即NO3向银电极移动。(3)当指针归零后,向右侧U形管中滴加数滴饱和NaC溶液,可观察到的现象是产生白色沉淀,溶液中Ag+浓度减小,平衡Ag+FeAg++Fe2+正向移动,Ag发生氧化反应为负极,电流表指针向左偏转。I.(4)HSˉ在硫氧化菌作用下转化为SO-的电极反应式为HS-+4H2O-8eSO2-+9H+(5)HS-、SO浓度不会发生变化,只要有两种细菌存在,就会循环将有机物氧化成CO2放出电子。

以上就是2019年至2022年英语周报七年级答案,更多英语周报答案请关注本网站。






